【Restriction Enzyme Cleavage of DNA 제한효소 실험세트】
실험 목적
· 특정 구간 DNA를 절단하는 도구인 제한효소에 대한 이해를 돕기 위함이다.
목차
1) 실험구성요소
2) 실험요구사항
3) 배경정보
4) 실험절차
① 실험개요 및 일반지침
② agarose gel 전기영동
③ 학습 질문
5) 강사지침
① 예비실험 및 참고사항
② 실험결과 및 분석
③ 학습 질문 및 답변
6) 부록
7) 물질 안전 보건 자료
유의사항
· 모든 구성품은 교육 연구만을 위한 것입니다. 진단 또는 약물 목적으로 사용, 소비되지 않아야 합니다.
· 이 실험은 사람 DNA를 포함하지 않습니다. (모든 실험 구성품은 사람에게서 추출된 것이 아닙니다.)
1) 실험 구성 요소
◑ 전기영동용 DNA샘플 로딩준비하기
A - 잘라지지 않은 플라스미드 DNA
B - Bgl I로 절단 한 플라스미드
C - EcoRI로 절단 한 플라스미드
D - 잘라지지 않은 Lambda DNA
E - EcoRI로 절단 한 Lambda DNA
F - Bgl I로 절단 한 Lambda DNA
☞ DNA샘플은 실온에서 보관 가능하나, 수령 후 1개월 이내에 실험을 하지 못할 경우 냉장보관 하시는 것이 좋습니다.
☞ DNA샘플은 로딩 전에 가열 할 필요가 없습니다.
◑ 시약 및 용품
· ultraspec-agarose powder
· 농축 된 전기영동버퍼
· FlashBlue™ DNA Stain
· InstaStain® Blue cards
· Practice Gel Loading Solution
· 1ml 피펫
· Microtipped Transfer Pipets
2) 실험 요구 사항
· 전기영동장치 수평 맞추기
· D.C. 전원 공급 장치
· 팁이 포함 된 자동마이크로피펫
· 균형
· 전자레인지, 핫플레이트 또는 버너
· 피펫 펌프
· 250ml 플라스크 또는 비커
· 장갑(화상 방지)
· 보안경 및 일회용 실험장갑
· 소형 플라스틱 트레이 또는 대형 중량 보트 (겔 분해용)
· DNA 시각화 시스템 (백색광)
· 증류수 또는 탈 이온수
3) 배경 정보
제한 효소의 발견은 분자 유전학의 새로운 시대를 열었다. 이 효소들은 매우 구체적이고 재현 가능한 방법으로 DNA 분자를 절단합니다. 이는 분자 복제와 유전자 지도 제작으로 이어지게 된다.
제한효소는 두 DNA 가닥 내의 인산염 결합의 구분을 촉매시키는 엔도뉴클레오아제다. 활동을 위해 Mg+2가 필요하며, 클레이브 지점에서 5 prime (5') 인산염과 3 prime (3' hydroxyl) 그룹을 생성한다. 제한효소의 구별되는 특징은 매우 특정한 염기서열에서만 잘린다는 것이며, 제한효소는 많은 다른 종의 박테리아(청녹색 조류 포함)로부터 얻어진다.
현재까지 3,000개가 넘는 제한효소가 발견되어 목록화 되어 있다.
제한효소는 분리 된 유기체에 따라 이름이 붙여지는데, 첫 단어의 첫 글자와 두 번째 단어 두 글자를 사용하여 이루어진다. 특정 종의 특정한 변종이나 기질만이 제한효소를 생산할 수 있다. 변형률이나 기압의 유형은 때때로 명칭의 종 지정을 따른다. 마지막으로 Roman nu-meral은 항상 동일한 유기체 또는 동일한 계통의 다른 기질에 의해 생성된 여러 가지 다른 제한효소 중에서 하나를 지정하기 위해 사용된다.
제한효소는 DNA를 절단하기 위해 핵산의 특정 이중 가닥 인식 서열을 필요로 한다. 인식 사이트는 일반적으로 길이가 4-8 염기쌍이다. 분열은 현장 내부 또는 부근에서 발생한다. 분열 위치는 화살표로 표시되어 있으며 인식 사이트는 대칭형인 경우가 많다. (즉, 5‘에서 3’까지 읽을 때 두 개의 DNA 가닥이 동일한 염기서열을 갖는다.) 이러한 서열은 회문(palindromes)이라고 한다. Eco RI의 인식 부위와 절단 패턴을 예로 들어보자.
5'-GAATTC-3' 5'-G AATTC-3'
3'-CTTAAG-5' 3-CTTAA G-5'
위와 같이, Eco RI는 인식 부위에서 엇갈린 절단을 일으킨다. 말단의 단일 가닥 부위가 상호보완적이기 때문에 DNA 단편의 말단을 “끈적” 또는 “접착력 있는” 말단이라고 부른다.
Hae Ⅲ 와 같은 일부 제한효소들은 서로 반대되는 절단 행위를 도입한다. 이런 종류의 균열은 무딘 끝을 만들어낸다.
5'-GGCC-3' 5'-GG CC-3'
3'-CCGG-5' 3'-CC GG-5'
일부 제한효소의 인식 사이트는 다양한 염기 위치를 포함한다. 예를 들어, Ava I는 :
5‘-CPyCGPuG-3' (Py = pyrimidine = C or T and / Pu = purine = G or A)
3'-GPuGCPyC-5'
A는 T와 G가 C와 함께 쌍을 이루고, 결과적으로 4개의 가능한 순서가 있다. 이런 유형의 인식 사이트는 퇴행성이라고 한다.
일부 인식 사이트는 특정 수의 완전히 다른 기준으로 구분된다. 예를 들어, Bgl I는 :
5‘-GCCNNNNNGGC-3' (N = A, G, C or T)
3'-CGGNNNNNCCG-5'
Bgl I가 쪼개 질 수 있는 625개의 순서가 있다. 효소가 진정으로 “인식” 하는 유일한 근거는 끝에 있는 여섯 개의 G-C 염기쌍이 팔레드롬을 형성한다. Bgl I 의 경우, 이러한 인식기준은 항상 5개의 염기쌍의 DNA로 분리되어야 한다. 그렇지 않으면 효소가 DNA와 제대로 상호작용하지 못하고 절단된다. Bgl I 와 같은 인식 사이트는 하이픈으로 된 사이트라고 한다.
일반적으로, DNA분자가 길수록 특정 인식 사이트가 발생할 가능성이 더 커진다. 따라서 30억 개의 염기쌍을 포함하는 인간 염색체 DNA는, 수천 개의 염기쌍만을 포함하는 플라스미드 DNA보다 더 많은 인식 사이트를 가지고 있다.
하지만, 매우 큰 DNA는 온전히 분리되기 어렵기 때문에 취급하는 동안 5만에서 10만개의 염기쌍의 범위에 있는 조각들로 무작위로 잘라진다.
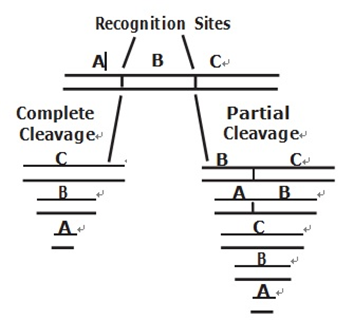
플라스미드 및 많은 바이러스성 DNA는 원형분자다. 원형 DNA가 제한효소에 대한 하나의 인식 부위를 포함한다면, 절단 될 때 선형 분자를 형성하게 된다. 반대로, 선형 DNA분자가 단일 인식 부위를 포함하는 경우 일단 절단되면 두 조각이 생성된다. 생산 된 조각의 크기는 인식 부위들이 서로 얼마나 멀리 떨어져 있는지에 달려있다.
DNA 분자가 제한효소에 대한 여러 개의 인식 사이트를 포함하는 경우, 특정 실험 조건 하에서는 특정 부위만 절단되고 다른 부위는 절단되지 않을 수도 있다. 이 불완전하게 쪼개진 DNA 조각들은 부품이라 불리며, 적은 양의 효소가 사용되거나 짧은 시간 후에 반응이 중단되면 부분적으로 발생 할 수 있다. 실제로, 부품들을 포함한 반응들은 완전히 분해 된 일부 분자를 포함한다.
아가로스 겔 전기영동은 제한효소에 의해 생성된 DNA조각을 분석하는데 사용되는 강력한 분리 방법이다. 아가로스 겔은 분자체 역할을 하는 미세한 모공으로 구성된다. DNA 샘플은 주조하는 동안 겔로 만든 웰에 넣는다. DNA는 중성 pH에서 강한 음전하를 가지기 때문에, 전기영동 중에 겔을 통해 양극으로 이동한다. DNA 분자는 크기와 모양에 따라 겔 안에서 분리되며, 더 작은 선형 조각들이 가장 빠르게 이동한다. 만약 두 조각의 크기가 비슷하거나 동일할 경우에는, 겔에서 함께 이동하게 된다. DNA가 여러 번 분해되면, 광범위한 파편들이 전기영동의 후유증으로 남게 될 것이다.
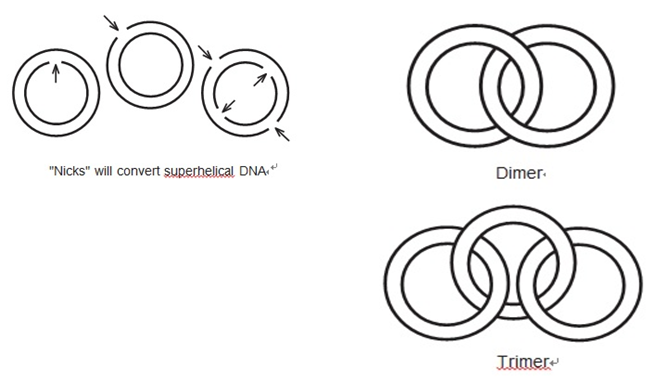
플라스미드와 같은 원형의 DNA는 슈퍼코일(DNA 등의 나선 구조를 가진 두 사슬이 다시 꼬인 상태.) 되어 있다. 슈퍼코일 된 DNA는 꼬여 있지 않은 형태(선형, 절단, 이완된 원)보다 더 작고 뒤얽힌 형태를 가지게 된다.
슈퍼코일 된 DNA가 제한효소에 의해 한 번 절단되면 선형 형태로 풀린다. 이 실험에서 사용 된 전기영동 조건에서 슈퍼코일 된 DNA는 선형 형태보다 빠르게 이동하고 선형DNA는 더 작은 원형 형태보다 빨리 이동한다.
복제하는 동안 여러 플라스미드 분자는 로킹 구조를 형성하게 되는데, 이러한 형태를 ‘캐터네인(동종의 원자)’ 라고 부른다. 케터네인은 두 개의 플라스미드 분자(이합체), 세 개의 분자(삼합체) 등을 포함하며, 전기영동을 하는 동안 손상 된 단일 원보다 더 느리게 이동한다. 이합체는 삼합체보다 빠르게 이동하며, 삼합체는 사합체보다 빠르게 이동한다. 캐터네인은 단일 제약 형태와 도일한 최종 제한효소 절단패턴을 야기한다.
이 실험에서 제한효소 절단제품은 아가로스 겔 전기영동으로 분석 될 것이다. 슈퍼코일 된 플라스미드 DNA는 대략 4,500개의 염기쌍을 포함하고 있으며, Bgl I을 위한 하나의 인식 사이트와 Eco RI를 위한 두 개의 인식사이트를 가지고 있다. 두 번째 DNA는 49,000개의 염기쌍을 포함하는 선형분자인 ‘대장균 박테리오파지 람다’에서 분리 된 것으로, 람다DNA는 Eco RI의 경우 5개, Bgl I의 경우 29개를 포함하고 있다. 제한 효소 소화는 다른 DNA를 소화 할 때 특정 제한 효소가 뚜렷하게 다른 패턴을 생성한다는 것을 보여준다. 예를 들어, Bgl I는 람다 DNA를 분해 할 때에, 플라스미드 DNA 소화 패턴과 비교하여 하나의 조각을 만든다.
4) 실험절차
①실험개요 및 일반지침
◑ 실험목표 : 이 실험의 목적은 특정 서열에서 DNA를 절단하고 도구로서 제한 엔도뉴클레아제의 사용에 대한 이해롤 증진시키는 것이다.
◑ 실험실 안전수칙
a. 장갑과 고글은 항상 착용해야 한다.
b. 시약의 가열 및 용해 할 때 사용되는 장비를 다룰 때에는 매우 주의해야 한다.
c. 피펫 시약을 입에 대지 말 것. - 피펫 펌프를 사용한다.
d. 전기 장비를 사용 할 때 주의해야 한다.
e. 시약이나 생물학적 물질을 취급한 후에는 항상 비누와 물로 손을 깨끗이 씻어야 한다.
◑ 실험 노트 기록하기 : 실험 노트에 다음 사항을 기재한다.
- 실험을 시작하기 전에 :
· 실험 진행 방향에 대한 가설을 쓴다.
· 실험 결과를 예측해본다.
- 실험 하는 동안에 :
· 관찰 결과를 기록하거나 사진으로 촬영한다.
- 실험이 끝난 후에 :
· 실험 결과로부터 설명을 작성한다.
· 실험이 반복되면 실험에서 무엇이 변경 될 수 있는지 찾아본다.
· 변경될 수 있는 점에 대해 가설을 작성해본다.
◑ 실험 개요 : 흐름도
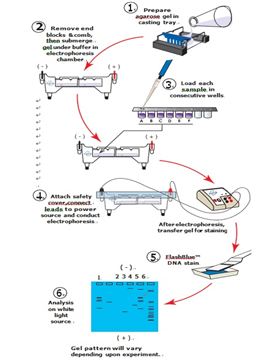
② 아가로스 겔 전기영동
◑ 겔 준비하기
a. 아래에 요약 된 사양을 갖춘 아가로스 겔을 준비한다. 강사는 사용 할 DNA염색체를 지정한다.
· 필요한 아가로스 겔 농도 : 0.8%
· 권장 겔 크기 : 7*7cm 또는 7*14cm (두개의 겔)
· 필요한 샘플 웰 수 : 6개
· 우수한 템플릿 배치 : 첫 번째 노치 세트(7*7cm), 첫 번째 및 세 번째 노치 세트(7*14cm)
◑ 샘플 로드
b. 튜브 A-F의 DNA샘플을 연속해서 웰에 주입한다.
· FlashBlue ™ 또는 InstaStain® Blue로 염색되는 겔의 경우 로딩 용량 30㎕로 주입한다.
· InstaStain® Ethidium Bromide로 겔을 염색하려면 로딩용량 18㎕로 주입한다.
· Premade Agarose Gel 을 사용할 경우 맥스 로딩 용량은 26㎕ 이므로 로딩용량을 주의해 주세요.
Lane Tube
1 A - 잘라지지 않은 플라스미드 DNA
2 B - Bgl I로 절단 한 플라스미드
3 C - EcoRI로 절단 한 플라스미드
4 D - 잘라지지 않은 Lambda DNA
5 E - EcoRI로 절단 한 Lambda DNA
6 F - Bgl I로 절단 한 Lambda DNA
◑ 겔 실행하기
c. DNA샘플이 로드 된 후 장치를 전원에 연결하고 필요한 전압으로 전원을 설정한다.
d. 전류가 제대로 흐르고 있는지 확인하고, 두 개의 백금 전극에 기포가 형성되는 것을 볼 수 있어야 한다. 강사가 지정한 시간 동안 전기영동을 수행한다.
e. 전기영동이 완료되면 DNA 염색 및 시각화를 진행한다. 염색 방법은 부록 E, F, G 또는 H에서 참고가 가능하다.
f. 광 기록법을 통해 겔의 결과를 문서화한다.
또는 투명 필름을 겔 위에 놓고 영구 마킹 펜으로 추적한다. DNA 띠의 이동 패턴 외에 겔과 샘플 웰의 윤곽도 포함 시켜야 한다.
③ 학습 질문
a. DNA는 어떤 적극으로 이동하며, 그 이유는?
b. 제한효소의 발견이 왜 중요한가?
c. 제한효소의 명칭은?
d. 제한효소의 기능을 간략하게 설명하시오.
5) 강사지침
① 예비실험 및 참고사항
수업 규모, 실험실 사용 시간 및 장비 가용성은 이 실험을 계획하고 구현할 때 학생들과 함께 고려해야 한다.
이러한 지침은 특정 환경에 맞게 조정 가능하며, 이 자료에서 질문에 대한 답을 찾을 수 없는 경우, “EDVOTEK" 웹 사이트에 다양한 자료로 확인 가능하다. 기술 서비스는 오전 9시부터 오후 6시까지 이용할 수 있으며, 전문 기술 직원 1-800-EDVOTEK(1-800-338-6835)의 도움을 받을 수 있다.
◑ 교육자원, 국가 콘텐츠 및 기술분야
이 실험을 통해 학생들은 샘플을 로드하고 아가로스 겔 전기영동 실행 방법을 배우게 된다. 실험 분석을 통해 학생들은 추상적인 개념을 구체화 할 수 있게 된다.
EDVOTEK Ready-to-Load 전기영동실험은 교실 환경에서 충분히 쉽게 수행할 수 있도록 설계되었지만, 실험 경험이 많은 학생과 교사조차도 가끔 어려움을 겪기도 한다. 그래서 EDVOTEK 웹 사이트는 전기영동을 실험을 진행하기 위해 필요한 정보와 자주 묻는 질문들에 대한 답변을 제공하고 있다.
◑ 고급 실험 및 보충 활동
더 넓은 범위로 실험을 하려면 EDVOTEK 실험 키트를 사용하면 된다. 예를 들어, DNA 마커가 다른 DNA 샘플과 병행되면, 모든 전기영동 겔 결과에서 DNA 사이즈 결정 활동을 수행해 볼 수 있다. DNA 사이즈 조정 지침 및 기타 고급 실험 안내 사항은 EDVOTEK 웹 사이트에서 참고 가능하다.
◑ 실험 시간 안내 사항
a. 겔 준비하기
일반적으로 겔을 응고하는데 20분 정도가 소요되므로 겔 준비 시간은 넉넉히 30분 정도로 두는게 좋다.
b. 피펫팅 및 겔 로딩
학생들이 마이크로피펫과 샘플 로딩 기술에 익숙하지 않은 경우, 실험을 진행하기 전에 피팅 연습 또는 겔 로딩 활동을 해보는 것이 좋다. 이를 위한 두 가지 방법을 제안한다.
· EDVOTEK Expt. #S-44 마이크로피팅 기본 사항은 마이크로피펫 사용에만 초점이 맞춰져 있다. 학생들은 다양한 염료 혼합물을 준비하고 전달함으로써 피펫 연결 기술을 배우게 된다.
· 겔 로딩 연습 : EDVOTEK 시리즈 100 전기영동실험은 이 실험을 위한 겔 로딩 용액 튜브를 포함한다. 염색 샘플 전달을 위해 별도의 아가로스 겔을 준비하는 것이 좋다. 이 활동은 학생들의 기술 수준에 따라 10분 정도 소요 될 수 있다.
c. 전기영동 실시
전기영동 시간은 약 15분에서 최대 2시간까지 다양하게 나타날 수 있으며, 전기영동 단위의 다른 모델은 설계 구성에 따라 다른 속도로 DNA를 분리한다.
일반적으로 전압이 높을수록 샘플이 더 빠르게 이동하지만, 최대 전압은 표시된 권장 값을 초과하지 않아야 한다.
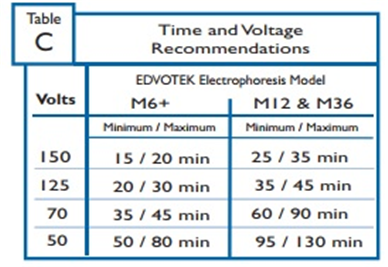
아래의 표C의 예는 시간 및 전압 권장사항을 나타낸다. (구체적인 실험지침은 부록A 또는 B의 표 C를 참고바람.)
◑ 전기영동용 아가로스 겔 준비
전기영동 실험을 위한 아가로스 겔을 준비하기 위한 몇 가지 옵션이 있다.
a. 개별 겔 제작 : 각 실습 그룹은 실험을 실시하기 전에 각자의 겔을 제작한다.
b. 그룹 겔 준비 : 한 묶음의 아가로스 겔을 학급이 공유할 수 있도록 준비한다. 시간을 절약하기 위해 많은 양의 ultraspec 아가로스를 클래스별로 준비하는 것이 좋다.
c. 겔을 미리 준비하기 : 겔은 사전에 제작해서 냉장보관 시 2주 간 보관 가능하기 때문에 미리 만들어두고 나중에 사용해도 무방하다. (※겔을 -20℃ 이하에 보관하지 마십시오. 동결 현상은 겔이 파괴될 수 있습니다.)
◑ 미리 준비 된 아가로스 겔 사용하기
보관을 위해 쟁반에서 겔을 꺼낼 경우에는, 전기영동용 장치에 넣기 전에 고온의 아가로스를 몇 방을 떨어뜨려 트레이에 고정시켜야 한다. 이렇게 하면 겔이 트레이에서 미끄러지거나 전기영동기기 내에서 떠다니는 것을 방지할 수 있다.
◑ 아가로스 겔의 농도 및 부피
겔 농도는 전기영동을 하는 동안 분자의 이동성에 영향을 미치는 요인 중 하나이며, 비율이 높을수록 튼튼하고 다루기가 쉽다. 그러나 분자의 이동성과 염색은 겔의 단단한 형태로 인해 오래 걸린다.
겔 부피는 트레이의 크기 뿐 아니라 전기영동 후 DNA 염색에 사용되는 염색 유형에 따라 달라진다.
InstaStain® Ethidium Bromide로 염색되는 겔은 FlashBlue ™ 또는 InstaStain® Blue로 염색되는 겔보다 적은 샘플 양 (부피)을 필요로 한다.
이 실험에는 0.8%의 겔이 필요하다. 이는 EDVOTEK 실험에서 염료 또는 DNA 단편을 분리하기 위한 일반적인 아가로스 겔 농도이다.
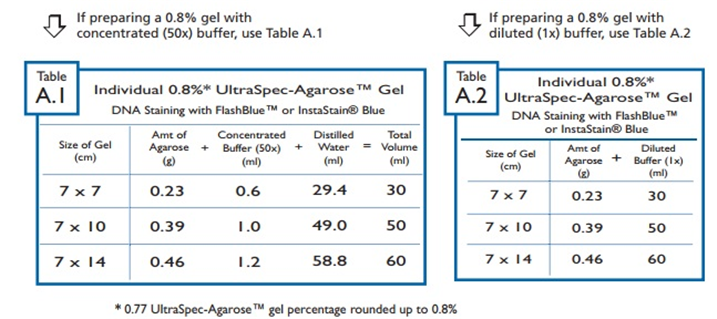
· FlashBlue ™ 또는 StaStain® Blue로 염색되는 0.8 % 겔을 제조하기 위한 사양은 부록 A에 나와 있다.
· InstaStain® Ethidium bromide로 염색되는 0.8 % 겔을 제조하기 위한 사양은 부록 B에 나와 있다.
아래의 표 A-1 과 A-2 는 부록 A의 표들이다. 첫 번째(왼쪽) 표는 농축 된 (50X) 버퍼를 사용한 시약 양을 보여주고, 두 번째(오른쪽) 표는 희석 된 (1X) 버퍼를 사용한 시약 양을 보여준다.
◑ 전기영동 후 겔 염색 및 탈색
DNA 염색약 FlashBlue ™ 및 InstaStain® Blue 는 EDVOTEK 표준 시리즈 100 실험에 포함된다. 시리즈 100-Q 실험에는 InstaStain® Ethidium Bromide (InstaStain® EtBr)가 포함되어 있다. InstaStain® 은 시간을 절약하고 액체 폐기물을 줄이는 독점적인 염색 방법이다. 또한, EDVOTEK 은 별도로 구매할 수 있는 단백질 폴리아크릴라미드 겔을 고정하기 위한 Protein InstaStain® 도 제공한다.
DNA 염색 옵션에 대한 지침은 부록에 제공된다.
· 옵션 1 : FlashBlue™ liquid - 부록 E
이 간단하고 신속한 액체 염색 및 탈색 과정은 최소 65분(5분 염색, 60분 탈색) 이내에 DNA 띠를 관찰할 수 있게 도와준다.
· 옵션 2 : Instastain® Blue 카드, 1단계 고정 및 제거- 부록 F
아가로스 겔은 쉬운 단계로 염색 및 탈색이 가능하다.
· 옵션 3 : Instastain® Blue 카드 - 부록 g
Instastain® Blue 카드를 사용하면 약 5~10분 내에 염색이 완료되고, 약 20분 동안 염색하고 난 뒤에는 DNA 띠가 보이게 된다. 결과는 추가 탈색과 함께 더 선명해질 것이다.
최상의 결과를 얻으려면 겔을 밤새 분해해야하며, 이렇게 하면 염색 된 겔이 탈색 용액에서 균형을 이루게 되어 밝은 파란색 배경과 대조되는 균일한 어두운 파란색 DNA 띠가 생성 될 것이다.
· 옵션 4 : Instastain® Ethidium Bromide - 부록 h
ethidium bromide로 염색하는 것은 매우 민감한 작업이며, UV transilluminator를 사용하여 5~10 나노그램의 DNA를 검출할 수 있다. ethidium bromide는 과학 연구자들이 일반적으로 사용하는 염료이다.
이것은 나열 된 돌연변이 유발 물질이며 이중 나선 내에 있는 염기 사이에서 교정을 하면서 DNA와 단단한 복합체를 형성하게 되고, 이 복합체는 자외선에 노출되면 강한 형광색을 보인다.
주의 : ethidium bromide는 나열 된 돌연변이 유발 물질이다. 마이크로그램에 ethidium bromide를 함유 한 InstaStain® EtBr 카드의 처분은 기존의 에티듐 브롬화 착색 절차에 의해 생성 된 대량의 액체 폐기물에 비해 최소화 된다. Instaintain® 카드와 겔을 폐기하는 것은 화학 폐기물에 대한 제도적 지침을 따라야 한다.
◑ 전기영동을 위한 DNA 샘플은 겔을 로딩하기 전에 가열할 필요가 없다.
EDVOTEK은 장비 구입을 최소화하고 시간을 절약할 수 있는 광범위한 전기영동 실험을 제공한다. 시리즈 100의 실험은 이미 사전 시험을 거치고 상온에서 보관 된 DNA 표본이 특징이다. DNA 샘플은 전기영동 분리를 위해 아가로스 겔에 즉시 전달 될 준비가 되어 있으며, 수조에서 예열 할 필요가 없다.
EDVOTEK 실험에서 전기영동 샘플과 시약은 다양한 형태로 포장되어 있다. 시리즈 100과 S-시리즈 전기영동 실험의 샘플은 다음 방법 중 하나로 포장된다.
a. 사전에 지정 된 Quickstrip™ 연결 튜브
b. 개별 1.5ml (또는 0.5ml) 마이크로테스트튜브
◑ 샘플 형식 : 사전 지정 된 Quickstrip™ 연결 튜브
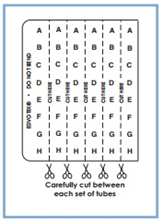
편리한 QuickStrip ™ 연결 튜브에는 사전 준비가 된 샘플이 담겨 있다. 샘플은 보호막으로 덮인 튜브의 마이크로테이터 블록으로 포장되어 있으며, 하나의 겔에 대한 전체 샘플 세트를 위해 튜브의 마이크로테이터 블록을 스트립으로 분리한다.
a. 아래 도표에 나타낸 것과 같이 가위를 사용하여 샘플들을 개별 스트립으로 분리한다.
(각 줄의 샘플은 갈 겔에 대한 전체 샘플 세트를 구성한다. 세트 당 샘플 수는 실험에 따라 달라질 수 있으며, 일부 튜브는 비어 있을 수 있다.)
b. 각 샘플을 신중하게 잘라야 한다. 샘플 튜브를 덮는 보호막을 절단하면 안 된다.
c. 각 겔은 하나의 샘플을 필요로 한다.
d. 학생들에게 겔을 장착하기 전에 튜브를 눌러 모든 샘플이 튜브의 하단에 있는지 확인하도록 해야 한다.
◑ 샘플 형식 : 개별 1.5ml 마이크로테스트 튜브
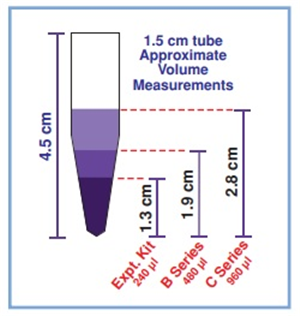
1.5ml 개별 마이크로테스트 튜브로 포장 된 샘플은 각 겔별로 나누어 줄 것을 권장한다. 이 형식으로 포장 된 DNA 샘플은 세 가지 표준 수량으로 사용할 수 있다.
Standard experiment kit 240 µl ※ 대량 주문은 요청 시 사용 가능
Bulk B-Series 480 µl
Bulk C Series 960 µl
a. 모든 샘플에서 증발 가능성을 확인한다. 만약 증발 현상이 일어나면 샘플들은 응고된다.
b. 필요 시 샘플 튜브를 누르거나 원심분리하고, 후에 증류수를 다음 수준보다 약간 높게 추가한다.
표준 실험 키트의 1.3cm 수준
B 시리즈의 경우 1.9cm 수준
C 시리즈의 경우 2.8cm 수준
c. 튜브를 여러 번 뒤집어서 잘 섞는다.
d. 샘플의 총량이 적절한지 확인한 후, 각 샘플을 0.5ml 또는 1.5ml 마이크로테스트 튜브에 적절히 분류한다.
· Flash- BlueTM 또는 Instaintain® Blue로 젤을 염색하는 경우: 각 샘플의 35-38 μl
· InstaStain® Ethidium bromide로 겔을 염색하는 경우 : 각 샘플의 18-20μl
e. 일부 샘플이 튜브의 측면에 붙어 학생들이 전체 샘플을 회수하는 데 어려울 경우, 원심분리하거나 탁상에 튜브를 두드려야 한다. 이를 방지하기 위해서는, 겔을 장착하기 전에 모든 샘플이 튜브 하단에 있는지 확인하도록 학생들에게 당부한다.
◑ 실험결과 및 분석
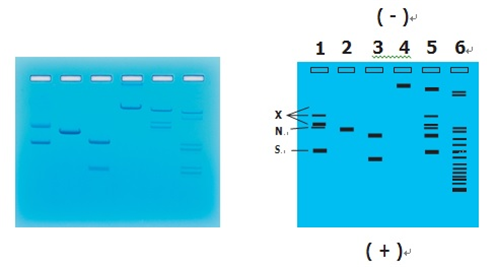
이 도식에서 DNA 단편의 상대적인 위치는 표시되었지만 실제 크기로 표시 된 것은 아니다.

더 작은 DNA 조각들은 얼룩들을 묶기 때문에 염색 후에도 잘 보이지 않을 수 있다. 크기가 비슷한 조각들은 개별적으로 분해되지 않을 수 있다.
▶ 학습 질문에 대한 답변은 키트 안내서를 참고하십시오.
◑ 부록
A. 0.8% Agarose gel electrophoresis reference tables
- For DNA staining with FlashBlue™ or InstaStain® Blue
B. 0.8% Agarose gel electrophoresis reference tables
- For DNA staining with InstaStain® Ethidium Bromide
C. Quantity Preparations for Agarose Gel Electrophoresis
D. Agarose Gel Preparation Step by Step Guidelines
E. Staining and Visualization of DNA
FlashBlue™ liquid
F. Staining ans Visualization of DNA
InstaStain® Blue One-step Staining and destainig
G. Staining ans Visualization of DNA
InstaStain® Blue Cards
H. Staining ans Visualization of DNA
InstaStain® Ethidium Bromide Cards
◑ 부록 A : 0.8% 아가로스 겔 전기영동 참조 표 (FlashBlue™ 또는 Instastain® Blue로 DNA염색)
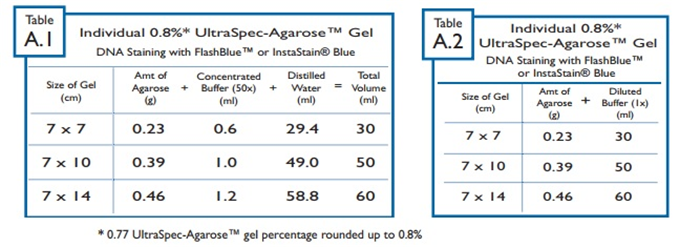
⇒ 농축 된 50X 버퍼로 0.8% 겔을 만든다면 표 1을 참고해서 사용.
⇒ 희석 된 1X 버퍼로 0.8% 겔을 만든다면 표 2를 참고해서 사용.
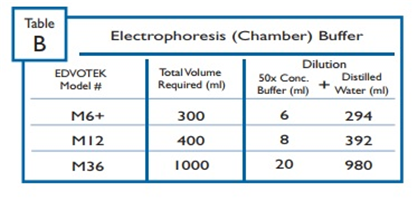
DNA 분석을 위해 권장되는 전기영동 버퍼는 PH 7, PH 8이다.
전기영동장치에 필요한 버퍼를 준비한다.
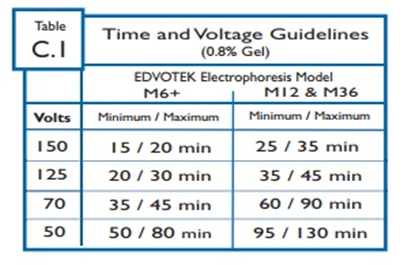
EDVOTEK 장비에 대한 시간 및 전압 권장사항은 표 C.1에 요약되어 있다.
전기영동 시간은 다양한 요인에 따라 약 15분에서 최대 2시간까지 다양하므로, 강사가 결정한 시간으로 전기영동을 실행하면 된다.
◑ 부록 B : 0.8% 아가로스 겔 전기영동 참조 표 (Instastain® Ethidium Bromide로 DNA염색)
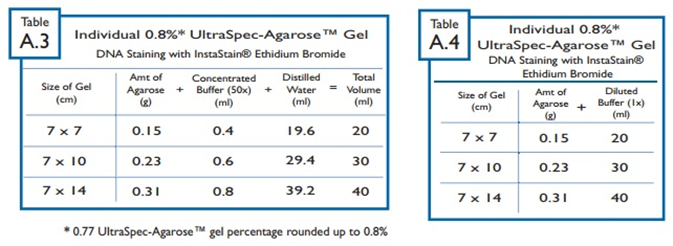
⇒ 농축 된 50X 버퍼로 0.8% 겔을 만든다면 표 3을 참고해서 사용.
⇒ 희석 된 1X 버퍼로 0.8% 겔을 만든다면 표 4를 참고해서 사용.
DNA 분석을 위해 권장되는 전기영동 버퍼는 PH 7, PH 8이다.
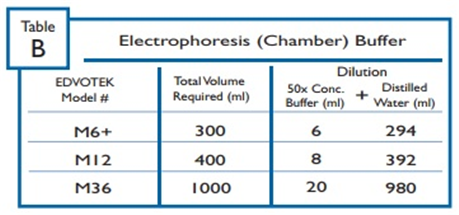
전기영동장치에 필요한 버퍼를 준비한다.
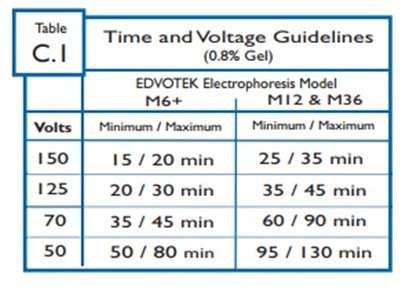
EDVOTEK 장비에 대한 시간 및 전압 권장사항은 표 C.1에 요약되어 있다.
전기영동 시간은 다양한 요인에 따라 약 15분에서 최대 2시간까지 다양하므로, 강사가 결정한 시간으로 전기영동을 실행하면 된다.
◑ 부록 C : 아가로스 겔 전기영동을 위한 수량 준비
- 시간을 절약하기 위해 전기영동버퍼와 아가로스 겔을 대량으로 준비하는 것이 좋다. 실험 후 미사용 된 버퍼는 후에 필요할 때 사용가능하며, 굳은 겔 용액은 다시 녹여 사용할 수 있다.
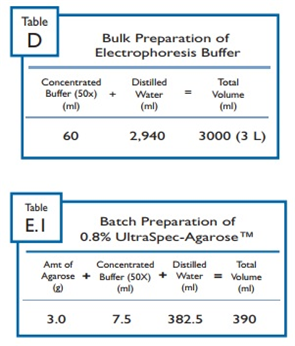
* 전기영동 버퍼 준비
- 3리터의 1X 전기영동버퍼에 대한 준비방법은 표 D를 참고한다.
* 아가로스 겔 준비
- 0.8% 아가로스 겔의 준비 방법은 표 E.1을 참고한다.
➀ 500ml 플라스크를 이용해서 희석 된 버퍼를 준비한다.
➁ 준비 된 버퍼에 UltraSpec-Agarose™ 3.0g을 붓고, 잘 섞어준다.
➂ 마킹펜으로 플라스크 외부에 용액 양을 표시한다.
➃ 앞서 설명한 대로 아가로스용액을 가열하여 개별 겔을 준비한다. 겔 버퍼 용액의 양이 많이 때문에 가열 시간을 알맞게 조정해야 한다.
➄ 아가로스 겔을 60°C까지 식힌다. 증발이 발생한 경우, 3단계에서 플라스크에 표시 된 원래의 양이 될 때까지 증류수를 넣어 용액을 만든다.
➅ 각 겔을 제조 할 때 필요한 냉각 된 아가로스 겔의 양을 분배한다. 필요한 양은 겔 베드의 크기와 사용되는 DNA 염색 방법에 따라 다르므로, 지침에 대해서는 부록A 또는 B를 참고하면 된다.
g. 겔이 완전히 굳도록 두어야 한다. 약 20분이 지나면 겔은 단단하고 차갑게 될 것이다. 그런 다음 전기영동 용 겔을 준비한다.
* UltraSpec-Agarose™ 키트 구성요소들은 각각의 양이 라벨로 붙어있고, 대부분 병의 내용물은 3그램이다. 라벨을 주의 깊에 읽어야 하며, 아가로스의 양이 명확하지 않거나 라벨이 지워진 경우 아가로스의 무게를 달아 올바른 양을 사용하고 있는지 확인해야 한다.
◑ 부록 D : 아가로스 겔 준비 - 단계별 가이드라인
* 겔 베드 준비
① 고무막대나 테이프를 사용하여 깨끗하고 건조한 겔 베드의 열린 끝을 막는다.
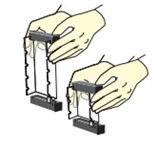
●고무막대 사용 : 겔 베드 양쪽 끝에 고무 댐을 설치한다.
이 때에 베드 측면과 바닥에 닿도록 한다.
●라벨 또는 마스킹테이프로 표시 :
· 3/4인치 폭의 테이프를 베드 옆면과 바닥 모서리 위로 펼친다.
· 펼친 테이프를 옆면과 바닥에 잘 붙이고 꾹 눌러 단단히 밀봉한다.
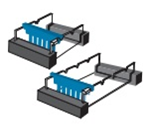
② 베드 끝 부분 첫 번째 홈에 템플릿을 놓는다. 템플릿이 단단하게 고정되었는지 확인한다.
* 아가로스 겔 제작
③ 250ml 플라스크 또는 비커를 사용하여 겔 용액을 준비한다.
④ 겔 준비를 위한 참조표(0.8%, 1.0%, 2.0%)를 참고하여 지정된 양의 아가로스 분말과 완충액을 첨가한다. 아가로스 분말의 덩어리를 분산시키기 위해 충분히 저어준다.
⑤ 마킹펜으로 플라스크 외부에 용액 부피의 수준을 표시한다.
⑥ 혼합물을 가열하여 아가로스 분말을 녹인다.
●전자파 방식
· 증발을 최소화하기 위해 플라스크를 비닐랩으로 덮는다.
· 혼합물을 가장 높은 전자파에 두고 1분간 가열한다.
· 모든 아가로스 분말이 완전히 용해 될 때까지 25초 동안 혼합물을 섞는다.
●핫플레이트 방식
· 증발을 최소화하기 위해 플라스크를 알루미늄 호일로 덮는다.
· 모든 아가로스 분말이 완전히 녹을 때까지 섞으면서 끓인다.
⇒ 최종 용액이 물처럼 보일 때까지 계속 가열한다. ‘크리스탈’과 같은 입자가 보이면 완전히 용해 된 것이 아니니, 가열하는 동안 용액을 주의 깊게 관찰해야 한다.
⑦ 아가로스 용액을 60℃까지 조심스럽게 돌려 열을 균등하게 분산시키도록 한다. 증발이 발생한 경우 증류수를 추가하여 5단계에서 표시한 원래 부피까지 용액을 채운다.
* 겔을 60℃로 냉각한 후 :
●고무 댐을 사용하는 경우 9단계로 이동하십시오.
●테이프를 사용하는 경우 8단계를 계속하십시오.
⑧ 아가로스 용액이 새지 않도록 겔 베드와 테이프를 밀봉한다.
●피펫을 사용하여 베드 양 끝에 소량의 냉각 된 아가로스를 넣는다.
●아가로스가 굳을 때까지 약 1분간 기다린다.
⑨ 베드를 평평한 표면에 놓고 식힌 아가로스 용액을 베드에 붓는다.
⑩ 겔을 완전히 굳힌다. 약 20분이 지나면 촉감이 단단해지고 차가워질 것이다.
* 전기영동용 겔 준비
⑪ 겔이 완전히 굳으면 조심스럽게 겔 베드에서 고무 댐이나 테이프를 제거한다. 고무 댐을 제거할 때 겔이 손상되지 않도록 주의해야한다. 얇은 주걱 또는 피펫 팁을 이용하면 쉽게 제거할 수 있다.
⑫ 템플릿을 천천히 잡아당겨 제거한다. 겔이 손상되지 않도록 주의한다.
⑬ 겔을 방향과 수평을 잘 맞춰 전기영동장치에 넣는다.
⑭ 전기영동장치 챔버를 적절히 희석 된 (1x) 버퍼로 채운다. (강사가 제공하는 부록페이지의 표 B 참조.)
⑮ 샘플을 로딩하고 전기영동을 진행하기 전에 겔이 버퍼에 완전히 잠겨있는지 확인한다.
◑ 부록 E : DNA FlashBlue™ 염색약을 이용한 시각화
●농축액에서 FlashBlue™ stain 준비
· 10x FlashBlue™ 10ml를 증류수 또는 탈이온수 90ml로 플라스크에 희석시킨다. 이 때 잘 섞어야 한다.
· 플라스크를 덮고 겔이 녹을 준비가 될 때까지 실온데 보관한다.
※ 전기영동장치에서 겔을 염색하지 마십시오.
※ 장갑과 글러브를 착용하십시오.
●염색 및 탈색
① 아가로스 겔을 베드에서 꺼내고, 1x FlashBlue™ 75ml가 들어있는 깨끗한 피펫 팁 랙 뚜껑에 완전히 담근다. 필요한 경우 염색약을 추가해서 겔을 완전히 담궈야 한다.
② 5분 동안 겔을 염색한다.
③ 겔을 다른 트레이에 옮겨 250~300ml의 증류수로 채운다.
④ 트레이를 몇 분마다 천천히 저어준다.
⑤ 겔을 20분 동안 처치한다. 이 때에 밝은 파란색 배경에 어두운 파란색 띠가 보일 것이다. 염색을 추가할 경우 더 선명한 결과를 볼 수 있다.
⑥ 탈수액에서 겔을 제거하고 가시광선 겔 시각화 시스템에서 겔을 검사한다. 가시광을 최적화하려면 EDVOTEK 장비와 함께 제공 된 황색 필터를 사용해야 한다.
●FlashBlue™염색 된 겔의 보관 및 폐기
· FlashBlue™로 염색 된 겔은 밀봉 가능한 비닐 백에 넣으면 몇 주 동안 냉장고에 보관할 수 있다.
(※ 겔을 얼리지 마십시오.)
· 보관하지 않은 겔은 고체 폐기물로 처리할 수 있으며, FlashBlue™ 염색약을 탈색시키는 용액은 배수구에서 처리하는 것이 좋다.
◑ 부록 F : Instastain® Blue를 사용한 염색 및 탈색 (One-step)
아가로스 겔은 InstaStain ™ Blue로 쉽게 염색 및 탈색이 가능하며, 이 방법은 약 3시간 내에 완료하거나 밤새 방치해서 사용가능하다.
※ 전기영동장치에서 겔을 염색하지 마십시오.
※ 장갑과 글러브를 착용하십시오.
① 7*7cm 아가로스 겔을 베드에서 꺼내어 증류수 또는 탈이온수 75ml가 들어있는 트레이에 겔을 완전히 담그거나, 전기영동버퍼를 사용한다. 이 때 주의할 점은 겔을 완전히 담가야한다.
② 장갑을 끼고, 염색 된 면(파란색)이 액체를 향하도록 7*7cm의 Instacain® Blue 카드를 띄운다.
(참고 : 7*14cm의 겔을 염색하는 경우 Instacain® Blue 카드 2개를 사용해야 한다.)
③ 겔을 약 3시간 동안 액체에 담근다. (증발을 막기 위해 랩으로 덮어두면 밤새 방치도 가능하다.)
④ 염색 및 탈색 단계를 거치면 이 겔은 시각화 및 사진 촬영을 위한 준비가 된 것이다.
●Instastain® Blue Card 및 겔의 보관과 폐기
· 염색 된 겔은 밀봉 가능한 비닐 백에 넣으면 몇 주 동안 냉장고에 보관할 수 있다.
(※ 겔을 얼리지 마십시오.)
· 사용 된 Instastain® Blue Card 및 처리 된 겔은 고체 폐기물로 처리 가능하다.
· 처리가 끝난 용액들은 배수구에 폐기한다.
◑ 부록 G : DNA Instastain® Blue Card의 염색 및 시각화
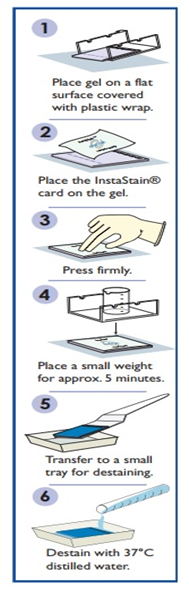
① 전기영동 후, 아가로스 겔을 랩으로 덮인 평평한 표면에 놓는다.
② 장갑을 끼고, Instastain® Blue Card의 파란색 염색 된 부분을 겔에 올려놓는다.
③ Instastain® Blue Card 전체 표면을 손가락을 이용해 잘 펴서 Instastain® Blue Card와 겔이 잘 접촉되도록 한다.
④ 겔과 Instastain® Blue Card가 잘 접촉 될 수 있도록 Instastain® Blue Card 위에 작은 빈 비커를 올려둔다.
⑤ Instastain® Blue Card가 5~10분 동안 겔에 묻도록 한다.
⑥ 염색 후 Instastain® Blue Card를 제거한다. 겔의 색이 매우 밝게 보인다면, 버퍼나 증류수로 젤 표면을 적시고 추가로 5분 정도 다시 염색한다.
● DNA의 탈색 및 시각화
⑦ 겔을 작은 플라스틱 용기에 옮겨 담는다.
⑧ 겔을 넣은 용기에 약 100ml의 증류수를 넣어 탈색시킨다.
⑨ 필요에 따라 증류수를 변경하여 탈이온화를 반복한다.
더 큰 DNA 밴드는 처음에는 밝은 파란색 배경에 어두운 파란색 띠로 보일 것이다. 겔이 완전히 탈색되면, 더 큰 DNA 밴드가 더 선명해지고 작은 밴드도 보일 것이다.
추가적으로 탈색을 진행하면 전체 배경이 균일한 밝은 파란색이 되며, 소요 시간은 20분~90분으로 다를 수 있다.
⑩ 탈색 용액에서 겔을 제거하고 가시광선 겔 시각화 시스템에서 검사한다. 가시광을 최적화하려면 EDVOTEK 장비와 함께 제공 된 황색 필터를 사용해야 한다.
⑪ 겔이 너무 가볍고 밴드가 잘 보이지 않는 경우에는 염색과 탈색 절차를 반복한다.
● DNA Instastain® Blue Card의 염색 및 시각화 계속 진행하기
▷ Instastain® Blue 제거 시 유의사항
· 37℃에서 가열 된 증류수를 사용하면 탈색이 가속화된다. 온도가 낮을수록 탈색이 오래 걸린다.
· 37℃를 초과하면 안 된다. 온도가 높을수록 겔이 연해지고 부러질 수 있다.
· 폐기 용 증류수의 양은 트레이 크기에 따라 다르니 겔을 수용할 수 있는 가장 작은 트레이를 사용해야 한다. 겔은 제거 되는 동안 완전히 잠겨 있어야 한다.
· 탈수를 위해 물의 변화를 3번을 초과해서는 안 된다. 과도한 탈색은 겔이 손상될 수 있다.
▷ Instastain® Blue Card 및 겔의 보관 및 폐기
· 염색 된 겔은 밀봉 가능한 비닐 백에 넣어 몇 주 동안 냉장고에 보관 할 수 있다.
(※ 겔을 얼리지 마십시오.)
· 사용 된 Instastain® Blue Card 및 처리 된 겔은 고체 폐기물로 처리 가능하다.
· 처리가 끝난 용액들은 배수구에 폐기한다.
◑ 부록 H : DNA Instastain® Ethidium Bromide 카드의 염색 및 시각화
※ 전기영동장치에서 겔을 염색하지 마십시오.
※ 장갑과 글러브를 착용하십시오.
① 전기영동 후 평평한 표면에 있는 비닐 랩 위에 겔을 올려두고,
전기영동버퍼 몇 방울을 떨어뜨려 겔을 적신다.
② 장갑을 끼고, 투명한 보호시트를 제거한 후 Instastain® EtBr 카드의 인쇄되지 않은 면을 겔 위에 올린다.
③ InstaStain® EtBr의 전체 표면을 꾹꾹 여러 번 눌러준다.
④ InstaStain® 카드가 겔 표면과 잘 붙을 수 있도록 상단에 겔 트레이와 작은 비커를
올려둔다.
이 상태로 3분~5분 정도 염색되도록 한다.
⑤ 10~15분 후, InstaStain® EtBr 카드를 제거하고, 겔을 LED Transilluminator로 옮긴 후 실험실 조명을 끄고 관찰한다.
이 때, 반드시 자외선 차단 고글을 착용해야 한다.
●Instastain 처분
- InstaStain® 카드 및 겔을 폐기할 때에는 화학 폐기물에 대한 제도적 지침을 따라야 한다.
●염색에 대한 추가 참고사항
· 밴드가 희미하게 보이거나 EDVOTEK UltraSpec-Agarose™를 사용하지 않는 경우, InstaStain® EtBr로 겔을 묻히는데 오랜 시간이 걸릴 수 있다.
염색을 반복하고 염색 시간을 추가로 10-15분 정도 늘리면 된다.
· 다른 DNA 샘플이 희미하거나 없는 경우에도 염색 후에는 DNA 마커를 볼 수 있어야 한다.
마커가 보이지 않는 경우 전기영동에 문제가 있을 수 있으니 원인 파악을 해야 한다.
Copyright (C) 2020 Biozoa All Rights Reserved

 다음글
삼투압 측정 실험 (1)
다음글
삼투압 측정 실험 (1) 
 이전글
브로콜리DNA 전기영동
이전글
브로콜리DNA 전기영동 



 로그인
로그인 회원가입
회원가입 주문조회
주문조회 관심상품
관심상품